ALUNO
- Home
- Cadastre-se
-
Questões
- Questões de Artes Cênicas
- Questões de Artes Visuais
- Questões de Atualidades
- Questões de Biologia
- Questões de Ciências
- Questões de Ciências Humanas
- Questões de Conhecimentos Gerais
- Questões de Educação Física
- Questões de Espanhol
- Questões de Filosofia
- Questões de Física
- Questões de Fisioterapia
- Questões de Francês
- Questões de Geografia
- Questões de História
- Questões de História e Geografia de Estados e Municípios
- Questões de Inglês
- Questões de Literatura
- Questões de Matemática
- Questões de Matemática Financeira
- Questões de Medicina
- Questões de Música
- Questões de Português
- Questões de Química
- Questões de Raciocínio Lógico
- Questões de Sociologia
- Provas
- Contato
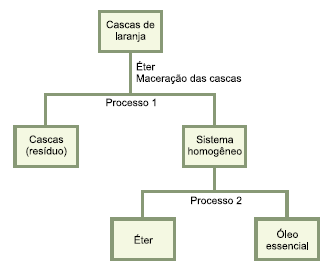
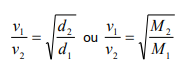 Em um laboratório, um observador estava à mesma distância de dois frascos idênticos: o primeiro continha metano (CH4) enquanto que o segundo continha metil-amina (CH3-NH2), ambos com cheiros característicos. Quando os frascos forem quebrados no mesmo momento o observador sentirá primeiro o cheiro de:
Em um laboratório, um observador estava à mesma distância de dois frascos idênticos: o primeiro continha metano (CH4) enquanto que o segundo continha metil-amina (CH3-NH2), ambos com cheiros característicos. Quando os frascos forem quebrados no mesmo momento o observador sentirá primeiro o cheiro de: 