cód. #6969
UNICENTRO - Química - 2018 - Vestibular - Química
A sociedade moderna não consegue mais viver sem os materiais produzidos a partir dos polímeros (do grego poli, muitas, meros, partes). Um polímero é uma macromolécula natural ou preparada artificialmente, formada por unidades estruturais que se repetem, os monômeros. Polímeros são empregados na fabricação de embalagens para bebidas, brinquedos, tubos e conexões para água, entre muitos outros. Entretanto, seu descarte inapropriado tem provocado problemas ambientais. Analise as questões seguintes, relacionadas aos polímeros.
I. Polímeros de eliminação são materiais obtidos a partir da reação entre monômeros iguais ou diferentes, com a liberação de substâncias mais simples, tais como a água, cloreto de hidrogênio, entre outros, com exceção do poliuretano. II. O cloroeteno, obtido através da adição parcial de cloreto de hidrogênio ao etino, é a unidade básica (monômero) do policloreto de vinila ou PVC. III. A borracha natural, um elastômero, polímero de alta elasticidade e fórmula (C5H8)n, é formada a partir do metilbut-1,3- dieno (isopreno). Também pode ser extraída da seringueira, Hevea brasiliensis. IV. Vulcanização é o nome que se dá ao processo de modificação da borracha com enxofre para acentuar determinadas propriedades como aumento de elasticidade e resistência a altas e baixas temperaturas. V. Copolímeros são obtidos através da reação de condensação de dois ou mais monômeros iguais, na presença de um catalisador, formando um polímero de estrutura ramificada.
É correto o que se afirma em
A) I, II, III e IV.
B) I, II e V.
C) III, IV e V.
D) I, III, IV e V.
E) Todas.
A
B
C
D
E
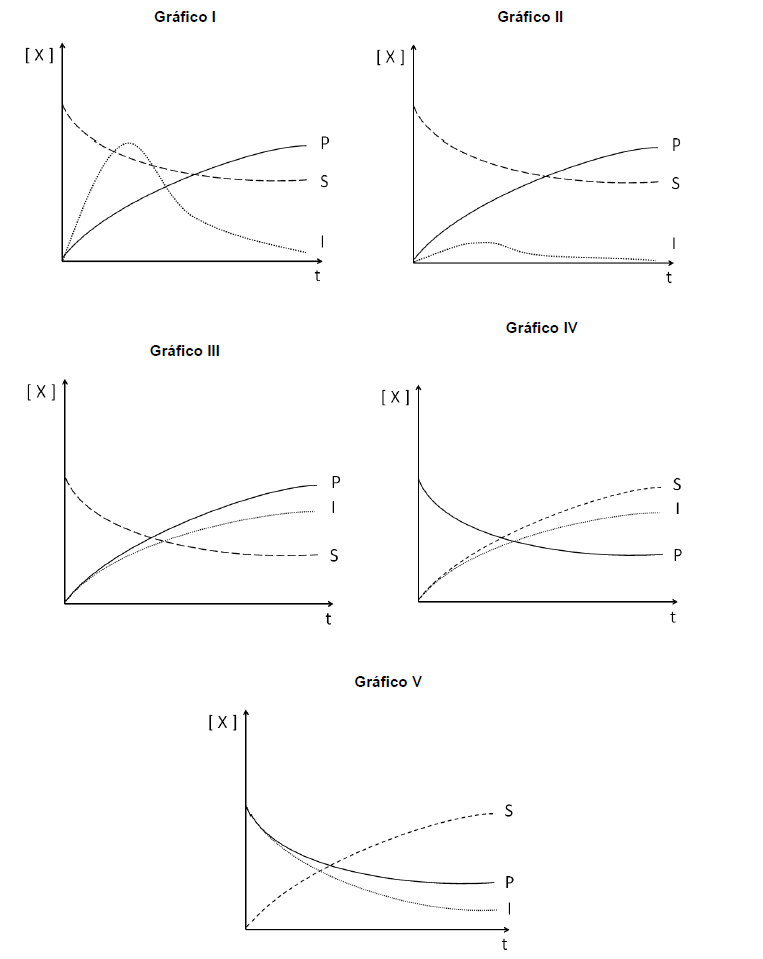 As curvas que melhor representam a variação das concentrações das espécies em função do tempo para o processo hipotético são aquelas associadas ao gráfico
As curvas que melhor representam a variação das concentrações das espécies em função do tempo para o processo hipotético são aquelas associadas ao gráfico 
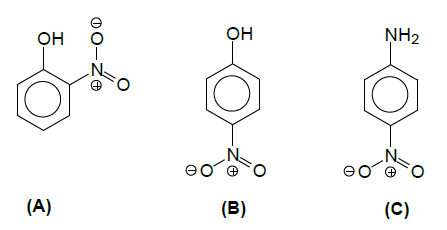

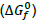 em torno de +12 kcal.mol-1 , a 25°C e 1 atm. A constante de equilíbrio desse processo está relacionada com a
em torno de +12 kcal.mol-1 , a 25°C e 1 atm. A constante de equilíbrio desse processo está relacionada com a 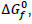 para certa temperatura T, através da relação
para certa temperatura T, através da relação 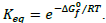 Após essas informações, verifica-se que a reação
Após essas informações, verifica-se que a reação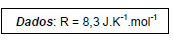
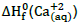 = -129,8 kcal.mol-1 ,
= -129,8 kcal.mol-1 , 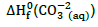 =-161,9 kcal.mol-1 e
=-161,9 kcal.mol-1 e 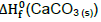 = -288,7 kcal.mol-1 a 298 K.
= -288,7 kcal.mol-1 a 298 K.