ALUNO
- Home
- Cadastre-se
-
Questões
- Questões de Artes Cênicas
- Questões de Artes Visuais
- Questões de Atualidades
- Questões de Biologia
- Questões de Ciências
- Questões de Ciências Humanas
- Questões de Conhecimentos Gerais
- Questões de Educação Física
- Questões de Espanhol
- Questões de Filosofia
- Questões de Física
- Questões de Fisioterapia
- Questões de Francês
- Questões de Geografia
- Questões de História
- Questões de História e Geografia de Estados e Municípios
- Questões de Inglês
- Questões de Literatura
- Questões de Matemática
- Questões de Matemática Financeira
- Questões de Medicina
- Questões de Música
- Questões de Português
- Questões de Química
- Questões de Raciocínio Lógico
- Questões de Sociologia
- Provas
- Contato

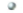 Cloro
Cloro  Cloreto de Hidrogênio
Cloreto de Hidrogênio 

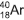 , originário do decaimento radioativo do potássio 40,
, originário do decaimento radioativo do potássio 40,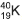 , e o xenônio tem nove, a exemplo do xenônio 129,
, e o xenônio tem nove, a exemplo do xenônio 129, , obtido a partir do decaimento do iodo radiativo 129,
, obtido a partir do decaimento do iodo radiativo 129,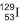 , que não existe mais nesse planeta. (CLAUDE; STEPHEN, 2013, p. 13).
, que não existe mais nesse planeta. (CLAUDE; STEPHEN, 2013, p. 13). 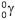 , pelo potássio 40 levou à formação do isótopo 40 do elemento químico argônio.
, pelo potássio 40 levou à formação do isótopo 40 do elemento químico argônio.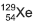 foi obtido pela emissão de uma partícula beta, , pelo iodo 129.
foi obtido pela emissão de uma partícula beta, , pelo iodo 129.